- 基因编辑技术应用造血干细胞治疗镰状细胞病和β-地中海贫血
- 来源: -- 时间:2021-01-15
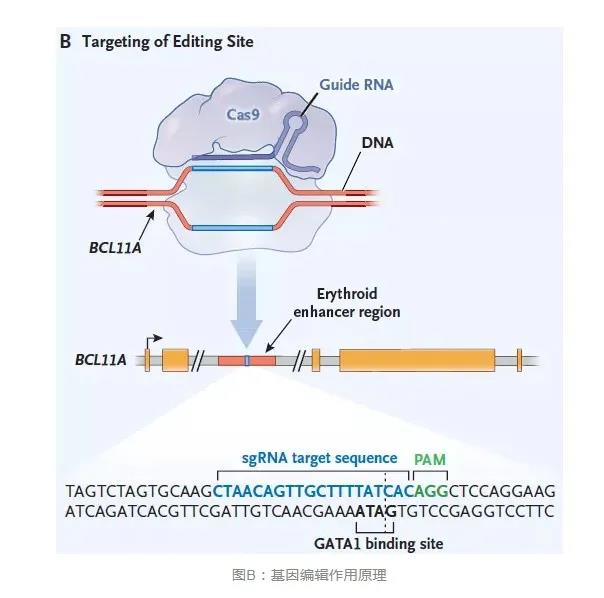
基因编辑技术是一种新兴的比较精确的能对生物体基因组特定目标基因进行修饰的一种基因工程技术,可对特定的目前基因进行编辑,获得预设定的目标基因。近些年尤其以CRISPR-Cas9技术最为火热,CRISPR-Cas9是细菌和古细菌在长期演化过程中形成的一种适应性免疫防御,可用来对抗入侵的病毒及外源DNA。而CRISPR-Cas9基因编辑技术,则是对靶向基因进行特定DNA修饰的技术,这项技术也是用于基因编辑中前沿的方法。以CRISPR-Cas9基础的基因编辑技术在一系列基因治疗的应用领域都展现出极大的应用前景,例如血液病、肿瘤和其他遗传疾病。该技术成果已应用于人类细胞、斑马鱼、小鼠以及细菌的基因组精确修饰。本研究主要通过CRISPR-Cas9(基因编辑技术)对造血干细胞的BCL11A进行编辑,进而治疗输血依赖性β地中海贫血(TDT)和镰状细胞病(SCD)。
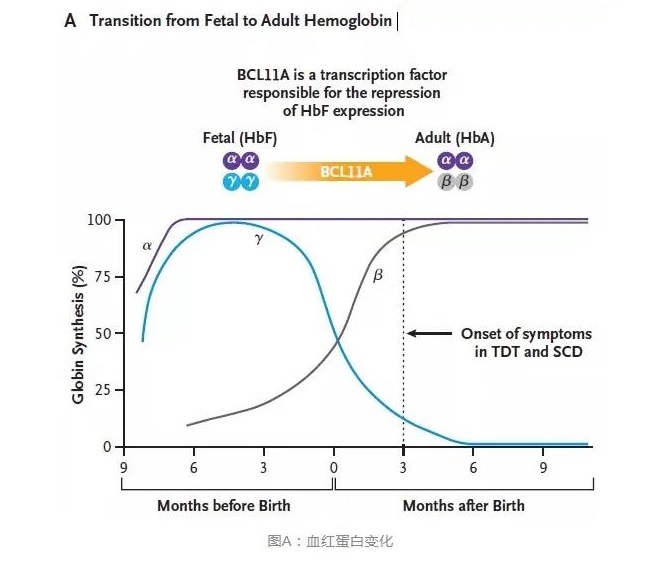
输血依赖性β地中海贫血(TDT)和镰状细胞病(SCD)是比较严重的单基因疾病,严重可能危及生命。BCL11A是一种转录因子,可抑制类红细胞中的γ-球蛋白表达和胎血红蛋白。作者从健康供体获得的CD34 +造血干细胞和祖细胞通过电穿孔法,利用CRISPR-Cas9针对BCL11A红系特异性增强子靶标进行编辑。该位点的等位基因约有80%被修饰,结果显示没有脱靶编辑的迹象。进行骨髓消融后,两名患者(一名患有TDT,另一名患有SCD)接受了针对同一BCL11A增强子的CRISPR-Cas9编辑的自体CD34 +细胞。一年多以后,验证两名患者的骨髓和血液中的等位基因编辑水平较高,全细胞分布的胎血红蛋白增加,输血独立性以及(对于SCD患者)消除了血管闭塞性发作。
结果讨论
两名患者在12个月内胎儿血红蛋白水平都达到预期,并且大量和持续的升高,全细胞率超过99%。这些发现表明,经CRISPR-Cas9编辑的造血干细胞进行了持久保存的移入,与胎儿血红蛋白水平高的红细胞的预期生存优势相符。两名患者的临床过程均支持我们的结论。
综上,造血干细胞在治疗输血依赖性β地中海贫血和镰状细胞病中有比较好的效果。脐带血中含有丰富的造血干细胞,并且脐带血还有许多其他类干细胞。例如间充质干细胞、内皮祖细胞、非限制性体干细胞等,这些都是人类宝贵的医疗资源,也期待科研人员有更深入的研究去开发脐带血的潜能。
参考文献:
Bauer DE, Orkin SH. Hemoglobin switching’s surprise: the versatile transcription factor BCL11A is a master repressor of fetal hemoglobin. Curr Opin Genet Dev 2015; 33: 62-70.
Piel FB, Steinberg MH, Rees DC. Sickle cell disease. N Engl J Med 2017; 376: 1561-73.
Haydar Frangoul, CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia, N Engl J Med . 2020 Dec 5. doi: 10.1056


